Kémiai
kötések képződése és felbomlása
(az
1999. évi kémiai Nobel-díj kapcsán)
A XX. Kémiatanári konferencia (Eger, 2002. aug. 21-24.) kiadványában megjelent összefoglaló
Keszei Ernő, ELTE Fizikai Kémiai Tanszék
(megtekinthető az előadáson vetített PowerPoint anyag, és letölthető ez a szöveg Word 2000 formátumban)
A XX. század elejére a tudományos közvélemény
általánosan elfogadta, hogy a kémikusok által régóta használt kémiai képletek a
valóságban is létező kis részecskéket jelölnek, amit a latin „súly”
(moles) szó kicsinyítő képzős alakjával molekuláknak neveztek. A
mérések alapján az is kiderült, hogy az egységül választott 2 g hidrogéngáz
elképzelhetetlenül nagy mennyiségű, 6,022 · 1023 db
molekulát tartalmaz. A folyékony, ill. szilárd anyagok sűrűsége és
atomtömege alapján világossá vált, hogy a molekulák mérete a 10-7 mm tartományba esik. Ettől kezdve tehát a kémikusok a kémiai
reakciókat úgy képzelték el, mint ilyen rendkívül kicsi, atomokból összetett
molekulák közvetlen találkozását (ütközését), átrendeződését, majd a
termékek szétválását. A statisztikus termodinamika és a kvantummechanika
fejlődése már a tízes-húszas években lehetővé tette ezen
átrendeződések molekuláris eseményeinek modellezését, de elsősorban
számítási nehézségek miatt ez kevés gyakorlati haszonnal járt. Mai
elképzeléseinket is meghatározó elméletet a reakciók molekuláris lefolyására a
magyar származású Polányi Mihály és az amerikai
Henry Eyring dolgozott ki
1935-ben. Az azóta általánosan elterjedt átmeneti állapot elmélet (más néven
abszolút sebességi elmélet) szerint a kiindulási anyagok molekulái, ha
elegendő energiára tesznek szert, speciális szerkezetű átmeneti
állapotba kerülnek, amely azután elbomlik a termékmolekulák keletkezése közben.
Az átmeneti állapot elmélet lassanként bekerült a
tankönyvekbe is, segítségével a legtöbb kémiai reakció jól értelmezhető.
Az átmeneti állapotban lévő molekulákat azonban egészen a 80-as évek
végéig semmilyen méréssel nem sikerült kimutatni. Azt már a 30-as években is
tudták, hogy a molekulák bomlása azok rezgési periódusidejének nagyságrendjében
történik, hiszen a bomlás úgy értelmezhető, mint egy olyan rezgés,
amelyben résztvevő atomokat távolodásuk során visszatérő erő nem
akadályozza meg a végleges szétválásban. A molekularezgések periódusideje pedig
rendkívül rövid; 10-14 .... 10-12 s nagyságrendbe esik. Ilyen rövid idő alatt
kellene a reakció lefolyását nyomonkövetni, illetve azt ennél rövidebb idő
alatt elindítani. Ez a feladat hosszú ideig megoldhatatlannak tűnt.
Szokásos, egyszerű kémiai kísérleteinkben a reagenseket összekeverjük, a
reakció pedig érzékszerveinkkel is nyomonkövethető idő alatt
játszódik le. A keveredés legfeljebb hangsebességű lehet, ami azt jelenti,
hogy 1 mm3 keveredéséhez is legalább 1 ezredmásodperc (1ms)
időre van szükség. Az 50-es évek elején
Manfred Eigen,
Ronald Norrish és
George Porter dolgozták ki a keverés nélküli reakcióindítás módszerét, amiért
1967-ben megosztott Nobel-díjat kaptak. Eszerint az előre összekevert
reagensek reakciója csak valamilyen hirtelen külső hatásra indul el. A
legjobban alkalmazható külső hatás egy alkalmas hullámhosszú fényimpulzus.
Ezzel a módszerrel a tanulmányozható reakcióidő azonnal 1 milliomod
másodperc (1 ms) nagyságrendűre csökkent.
A reakcióidő további csökkentése az
impulzuslézerek megalkotása után vált lehetővé. 1982-ben sikerült
először festéklézerek alkalmazásával előállítani az átmeneti állapot
feltételezett élettartamának nagyságrendjébe eső, 10-13 s (0,1 ps, vagy 100 fs) hosszúságú
lézerimpulzusokat. Ezek alkalmazásával lehetővé vált az ún.
ultragyors lézerfotolízis, amelynek során a pikoszekundum (10-12 s) töredéke alatt indítható reakciók lefolyását
szub-pikoszekundum időskálán lehetett nyomonkövetni egy másik lézerimpulzus
segítségével. Az új módszer kifejlesztésében és különösen annak az átmenti
állapotok kísérleti megfigyelésére történő alkalmazásában meghatározó
szerepe volt Ahmed Zewail egyiptomi származású amerikai kémikusnak, aki ezért a
tevékenységéért elnyerte az 1999. évi kémiai Nobel-díjat.
Nézzük,
hogyan működik egy ilyen ultragyors lézerfotolízis berendezés, amit a
Zewail által meghonosított kifejezéssel
femtokémiai berendezésnek is nevezhetünk. A mérés elvének leírása előtt
tisztáznunk kell, hogy időt mérni femotoszekundum felbontással semmilyen
elektronikus órával nem lehet, hiszen a leggyorsabb ilyen berendezések (pl. a
számítógépekben használt mikroprocesszorok) frekvenciája is legfeljebb
1 GHz, ami csak 10-9 s (nanoszekundum) felbontást tesz lehetővé. Az időmérést
ezért a fény által megtett út mérésére vezetjük vissza. A fény 1 fs (10-15 s) alatt 0,3 mm utat tesz meg, amit mikrométercsavar
segítségével még jól mérhetünk. A
femtokémiai mérőrendszer egy
lézerforrásból származó két fényimpulzussal működik.
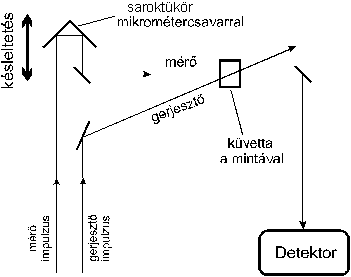
1. ábra. A gerjesztő és mérő
impulzusok közötti idő beállítása femtoszekundum időfelbontással,
saroktükörrel szabályozott késleltetés alkalmazásával.
Az egyik impulzus a reakciót indítja, a másik segítségével pedig mérhető
a reakció során bekövetkező változás annak elnyelését, vagy a hatására
kibocsátott fluoreszcens fény erősségét vizsgálva. A reakció indításától a
mérésig eltelt idő egy késleltető berendezés (ún. saroktükör)
segítségével állítható be, amely a mérő impulzus fényútjának
változtatását, ezzel egyúttal a reakcióelegybe érkezésének az indító impulzus
érkezésétől mért idejét szabályozza. Egy adott késleltetés
(reakcióidő) beállítása után a lézerberendezés egy impulzust küld a minta
felé. Az indítóimpulzus kiváltotta reakciót kísérő változást észleli a
késleletetési idő elmúltával a mintába érkező mérő impulzus,
amit a mintán áthaladás után a detektor érzékel. A detektor az érzékeléshez kb.
10-8 s
körüli időt (10 millió fs-ot) igényel, de a következő mérés sem indul
ennél hamarabb, így a mérésre bőven van idő. A következő mérés
általában 10-6 s
(109 fs) múlva kezdődik. (Érdemes itt átgondolni, mit is
jelent az, hogy az 1 ps körüli időtartam alatt lejátszódó reakciót
csak 1 millió ps múlva ismétlik meg. Ez megfelel annak, mintha egy 1 perc alatt
lejátszódó reakciót csak kb. két évenként egyszer végeznénk el egy sorozatmérés
közben.)
A fent vázolt berendezéssel 1987-ben
Ahmed Zewailnak
sikerült először kísérletileg bizonyítania, hogy a molekulák szintjén
valóban egy átmeneti állapot elbomlása vezet a reakciótermékekhez. Mérései
során a jód-cianidot (ICN) sugározta be egy 306 nm hullámhosszú
gerjesztő lézerimpulzussal, amely ennek hatására átalakult egy lazított
kötésű I····CN átmeneti állapotú molekulává, amely átmeneti állapot azután
kb. 200 fs alatt szétvált I atomra és CN gyökre. Eközben 390 nm-hez
közeli hullámhosszú mérőimpulzus hatására fluoreszcens fényt bocsátott ki,
amelynek erősségét mérve vissza lehetett következtetni az elbomló átmeneti
állapot szerkezetére. Ez volt az első olyan kísérlet, amely közvetlen
bizonyítékát adta a harmincas években valószínűsített és azóta a reakciók
lefolyásában jelentősnek gondolt átmeneti állapot kialakulásának és
elbomlásának. A kísérletek alapján egyúttal vissza lehetett következtetni a
gerjesztett állapotra (a disszociációt megelőző átmeneti állapotra)
jellemző potenciális energiára is az I és CN közötti távolság függvényében
(ld. 2. ábra).
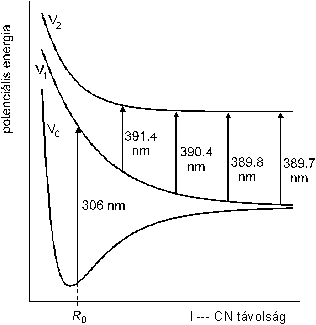
2. ábra. A jód-cianid disszociációjának ábrázolása
az I és CN közötti távolság függvényében mérhető potenciális energia
diagramban. A 306 nm hullámhosszúságú gerjesztő impulzus hatására a
stabilis ICN a V0 alapállapotból a V1
gerjesztett állapotba jut. Ez az átmeneti állapot, amelyben az I és a CN között
csak taszító kölcsönhatás van, ezért a molekula disszociál. A disszociáció
folyamán az ábrán feltüntetett különböző hullámhosszúságú
mérőimpulzusok az átmeneti állapotot különböző kötéstávolságok esetén
– így különböző késleltetési időknél – gerjesztik tovább hatékonyan a
V2 állapotba. E gerjesztés után a molekula egy fluoreszcens
foton kisugárzásával kerül vissza a V1 állapotba, amit a
mérőrendszerben detektálnak.
A jód-cianid fotolízise ún. monomolekulás elemi
reakció, amelyben egyetlen reagáló molekula szerepel, a disszociáció pedig az
elnyelt foton energiájának felhasználásával következik be. A gyakorlatban nem
ez a tipikus reakció, hanem az ún. termikus aktiválású reakciók, amelyekben a
reakciópartner molekulák ütközése során alakul ki az átmeneti állapot azok
összekapcsolódásával, az átalakuláshoz szükséges aktiválási energia pedig az
ütközésből származik. Bimolekulás reakciók femtokémiai vizsgálata azért
nehéz feladat, mert a fényelnyelés ugyan a fényimpulzus mintába érkezésekor
azonnal lejátszódik, azonban a molekulákat nem könnyű arra rávenni, hogy
ilyen rövid idő (10-100 fs) alatt egyszerre ütközzenek.
Ahmed Zewail
ezt a feladatot is elegánsan megoldotta. A molekuláris reakciódinamikában
régóta alkalmazott szuperszonikus molekulasugarat használta erre a célra. Ha
egy közepesen kis nyomású (kb. 1/3 légköri nyomású) kamrából egy fúvókán
keresztül héliumgázba kevert hidrogén-jodidot és szén-dioxidot engedünk ki
vákuumba, akkor a két molekula lazán (van der Waals kötéssel) kötött I-H····O = C = O komplexet
képez. Ezt a molekulasugarat keresztezték
Zewail és munkatársai egy 100 fs
szélességű gerjesztő lézerimpulzussal, aminek elnyelésekor a
komplexbe kötött HI molekula disszociált, a belőle kiszabaduló H atom
nekilökődött a CO2 molekula oxigénjének, és így a fényimpulzus
hatására egyszerre sok molekuláris ütközés történt. Az ütközés után az alábbi
reakció játszódott le:
H· + O = C = O ®
HO····C = O ®
HO· + C = O
A gerjesztő impulzust követően
különböző késleltetési idők után érkező mérőimpulzus
segítségével sikerült nyomonkövetni a HO····C = O átmeneti komplex
bomlását OH gyökre és szénmonoxidra, eközben mérve a szétbomló komplex
elnyelési színképének változását. A mérések tanúsága szerint ez a reakció
hosszú ideig, kb. 2000 fs-ig tart, ami bizonyítja, hogy bomlása előtt az
átmeneti állapotú molekula egy viszonylag stabilis szerkezetű alakjában
több molekularezgés ideje alatt fennmaradhat. Kvantumkémiai számításokkal
sikerült megtalálni ezt a viszonylag stabilis szerkezetet, amely miatt a bomlás
ennyire lassú.
Zewail úttörő kísérletei óta már több mint 10 év
eltelt. Ez alatt az idő alatt a femtokémiai kísérleti módszert sok más
laboratóriumban is sikeresen alkalmazták. A módszer elterjedését az is
elősegítette, hogy időközben a festékoldatlézereket a sokkal olcsóbb
szilárdtest lézerek váltották fel. Hamarosan elindulhatnak a mérések
Magyarország első femtokémiai laboratóriumában is, amelynek kialakításán
az MTA Szilárdtestfizikai és Optikai Kutatóintézetében dolgozunk.
A femtokémiai módszer alkalmazása számos új eredményt
hozott. Ezek közül kiemelném a látás mechanizmusának, ill. a fotoszintézis
kezdeti, nagy hatékonyságú energiamegkötő lépéseinek részletes
felderítését. Mindkét folyamat során pikoszekundumnál rövidebb idő alatt
végbemenő elektronátadási és energiaátadási folyamatok játsszák a
meghatározó szerepet, amelyeket csak a
Zewail által meghonosított módszerrel
lehetséges kimutatni. A közeljövőben várható az is, hogy a femtokémia a
tudományos laboratóriumok költséges kutatómódszeréből a hétköznapi
gyakorlatban is alkalmazott eszközzé válik, és a kémiai technológia, valamint a
gyógyítás szolgálatában még előre nem látható új lehetőségeket nyit
meg.
Magyar
nyelven az előadás témájáról további részletek olvashatók az alábbiakban:
Keszei Ernő:
Nobel-díj femtokémiai kutatásokért.
Természet Világa, 131/1, 10 (2000)
Keszei Ernő: Femtokémia: a
pikoszekundumnál rövidebb reakciók kinetikája,
A kémia újabb eredményei, 86. kötet, Akadémiai Kiadó Budapest, 1999